わが身を削ってでも守り切る!防食アノード大実験!!!
こんにちは
身近な興味を研究調査、Rプロジェクトの時間です。
今回調査するのはジェットやボート、そして船外機にも使用されている「防食アノード」 という部品にスポットを当てていきたいと思います。
この「防食アノード」という部品は、読んで字のごとく金属の腐食を防ぐ為の亜鉛でできたパーツです。



しかし、「金属の腐食を防いでくれている部品」と言われても、中々ピンと来ない方もいるかと思います。
そこで、今回のRプロジェクトでは防食アノードの効果を確かめる為、ある実験を行い「防食アノードの役割」
そして「金属の腐食のメカニズム」
この2つを学んでいく内容になります。
では、そもそも「金属の腐食」とは、どのような事を言うのでしょうか?
金属の腐食とは・・・
金属がおかれた環境によって、金属の表面に化学反応が起こり、外見やその機能が損なわれていく様の事を言います。
例えばですが、雨ざらしになった鉄はサビが発生し、強度が落ちてしまう上、素手でボロボロと崩れてしまいますよね。つまりこのサビというのも金属の腐食の一種であるとお考え下さい。
では本題に入りまして、
防食アノードがどのように海中、また水中で使用される金属の腐食を防いでくれているのか、実際に実験をしながら確かめていきましょう!
用意したのは
海水の入った500mlのペットボトル2本。
その中に金属(スパークプラグ)を投入させました。
画像で分かる通り、片方には防食アノードが金属と接触する形で投入されています。
長期実験が予想されますが、変化が現れるまで気長に待ちましょう!

―実験開始から2週間後―
「防食アノード無」のスパークプラグに変化が現れてきました。
スパークプラグの表面や、容器の底に白っぽい物質が沈殿しているのが分かると思います。
これも間違いなく金属の腐食、その変化が確認できます。

「防食アノード無」に、いったい何が起こっているのか…
科学的な説明では、金属の表面が酸化還元反応によって
金属の電子が失われ、イオン化されたことで、金属面からイオンがボロボロと脱落していったと考えられます。
海水にも酸素はある事から、金属の内部構造の原子と自由電子、その中の電子(自由電子)
が水分に取り込まれる(水分には酸素も取り込まれている)と水酸化鉄イオンが生まれます。
沈殿している白っぽい物質の正体は水酸化鉄イオンでしょう。
では、電子を失った金属の原子ですが、プラス(+)の鉄イオンとなってしまいます。
この鉄イオンはさらに、電子を引き寄せようと周りの酸素や水と結合をしていき、最終的に出来上がるのは酸化鉄!これはサビの主成分です。
今回の実験では水溶液中なので反応が遅いかもしれませんが、プラグを外気に触れさせると腐食(酸化)は一気に加速する事でしょう。

ちなみに「防食アノード有」は大した変化はありませんでした。
まだ2週間、さらに経過を見ていきましょう!
―実験開始から25日経過―
「防食アノード有」は依然、変化が見られませんが、対照的に「防食アノード無」は金属の腐食の進行が確認できます。
まず、前回は白っぽい物質、水酸化鉄イオンの発生がありましたが、水中での酸化が進むにつれ今回のようなサビ色に変化していったと思われます。

これもいわゆる赤サビ(※厳密には主成分)というものです。
では日常生活で最も目にするこの赤サビの性質についても考えていきましょう!
赤さびは酸の溶液などに溶けやすい性質を持ち、表面の隙間が多い構造になっています。
そのため、水分や酸素が金属内部に入りやすく、サビが奥の方へ広がり、やがて全体がボロボロと腐食してしまう厄介な性質を持っています。

そして、余談ではありますが、赤サビに対してあるのが黒サビ!
どちらも酸化還元反応によって生まれますが、熱した鉄に空気中の酸素と化合して生まれるのが、黒サビです。
黒サビは酸素や水分を金属内部に通さない性質を持っているので、「赤サビ防止の為に、黒サビ加工をする」なんて技術もあるみたいですよ

さて、少し脱線しましたが、さらに経過を見ていきましょう!
―実験開始から35日経過―
「防食アノード無」の方は、上でも説明した赤サビの褐色が強くなりましたが、これといった変化は見られません。
さて、そろそろ防食アノードについて触れて行きたいのですが、「防食アノード有」の方は依然、変化がありませんね。

このまま金属の腐食をすることがないのか!?
実験の区切りとして、50日間を予定しているので、残り15日間の経過を待ちましょう!
―実験開始から50日経過(最終日)
さて、ご覧のとおりここで一つの結果が分かりました!
「防食アノード有」のスパークプラグは見事に腐食を防いでいます!!

本題に入ります。
なぜ、防食アノードが投入されている金属(スパークプラグ)は腐食する事が無かったのか?
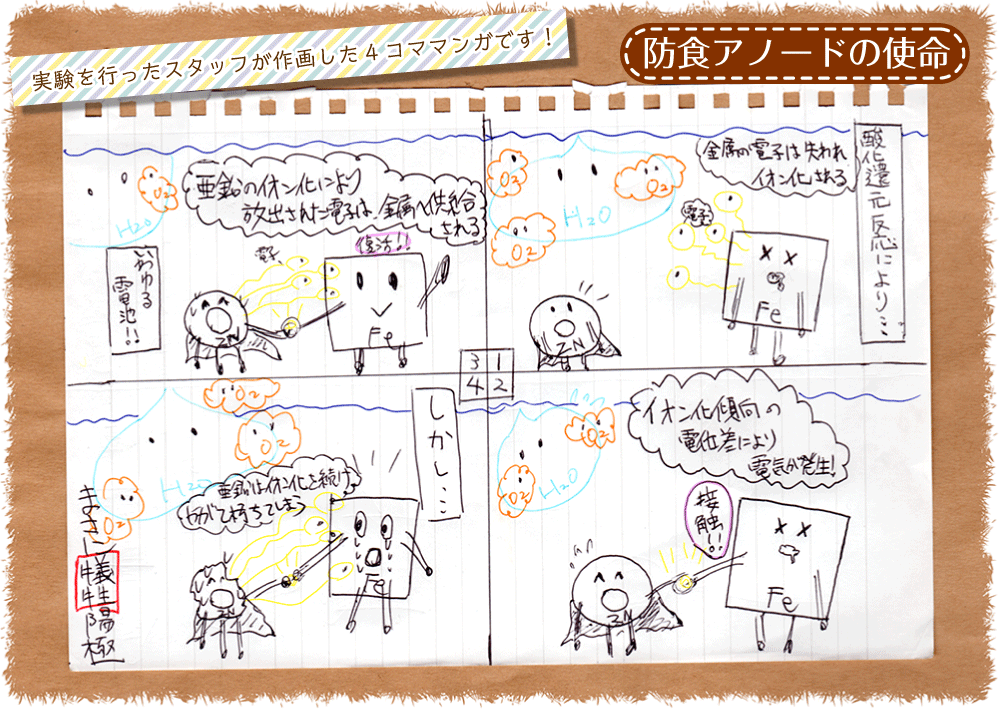
この防食アノードを使用する方法は、犠牲陽極といい、名前の通り金属が腐食する代わりに犠牲陽極であるアノードが腐食を引き受けている。イメージはこんなところでしょうか。
実験では「防食アノード」無の金属が腐食してしまう原因の一つに、金属の電子がイオン化されてしまうという説明をしたと思います。
金属にもあらゆる種類があり、海水などの溶液中にイオンとなりやすい金属と、なりにくい金属が存在します。これをイオン化傾向と言います。
参考に表を用意しました。
アノードは亜鉛です。
そして実験用のスパークプラグは、電極にはイリジウムやプラチナ等使用されていますが、今回は鉄!としてお考えください(使用されているでしょう笑)
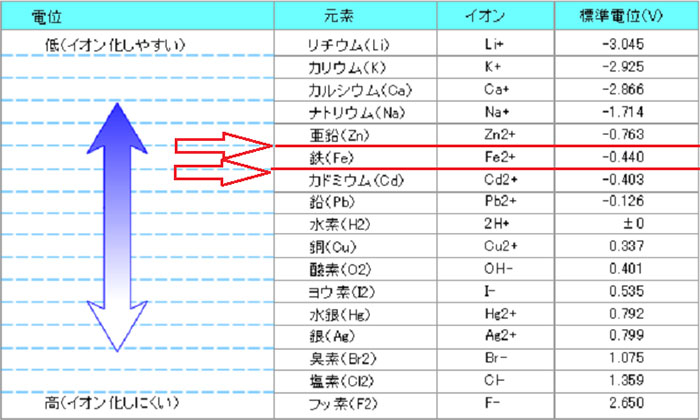
表を見て分かるように、亜鉛と鉄では、亜鉛の方がイオン化しやすい傾向、つまり腐食しやすい事が分かります。
このイオン化傾向の異なる、亜鉛と鉄を接触させることで、イオン化傾向の電位差というものが生じます。
電位というのは、金属そのものが持つ静電エネルギー。ややこしいですが電圧ともとれます。
この電位差を利用して、亜鉛から鉄へ電流を流す事で、金属に電子を供給させる事が出来ます!

先ほども言いましたが、金属の腐食は電子が失われてイオン化される事!
もし常に電子を供給することが出来る電池のようなものが有れば、腐食は起こりえない!という事にもなります。
そしてその電池の役目をしているのが、今回の主役防食アノードです!
文章だけでは分かりにくいと思いますので、4コマ風にイラストも用意しました。
題して「防食アノードの使命」
イラストの方にも触れましたが、防食アノードはイオン化が進行され、しまいにはボロボロと朽ちてしまう運命です。
では、この画像をご覧ください。
実験で50日間、海水に沈められた防食アノードと新品の防食アノードを比較してみました。

実験で使用した防食アノードには、若干白っぽい斑点のようなものが確認できると思います。
これは、「塩害による塩」ではなく実は、サビなのです!
亜鉛特有の白サビとも言われますが、防食アノードは消耗品という事が分かるかと思います。
また乗り手の使用状況などでアノードの腐食スピードに個人差はありますが、最低でも毎シーズンに一度は点検をした方がいいパーツとも言えるでしょう!
いかがでしたか?
「防食アノード」という部品についてお分かりいただけたでしょうか?
今後もマニアックで奥深い内容を、皆様にお届けしていきたいと思います。 ではまたお会いしましょうー!
<ボーターズ Rプロジェクトチーム>
※身近な興味を研究調査する、それがRプロジェクト